Forschung
Das Ziel unserer Forschung ist es, die molekularen Strukturen, Funktionen und Regulation von Redoxsystemen an der Zellmembran aufzuklären. Im Fokus stehen Prozesse der Nährstoffaufnahme, der Produktion & Entgiftung von reaktivem Sauerstoff (ROS), der Signalweiterleitung und der Redoxhomöostase.
Standard-Systems - Struktur & Funktion
 |
|
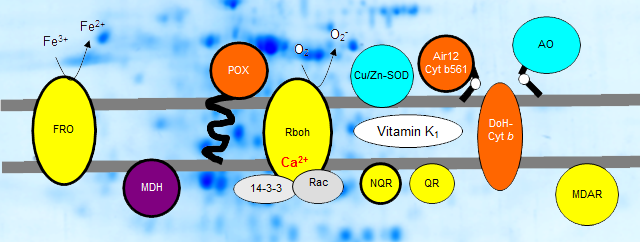
Die Plasmamembran bildet die äußere Barriere der Zelle. Sie erfüllt wichtige Funktionen in der Signalerkennung und -weiterleitung, bei Transportprozessen, der Zellwandbiosynthese und -modifikation, Entwicklungsprozessen und der Stressantwort. Vor etwa 40 Jahren wurde erstmals ein konstitutives transmembranes Elektronentransportsystem - das Standardsystem - in der Zellmembran von Eukaryoten nachgewiesen. Zeitgleich wurde ein weiteres transmembranes Elektronentransportsystem (Turbo-System bzw. Eisenchelatreductase, FRO) in Wurzeln charakterisiert, das durch Eisenmangel induziert wird. Bei Strategie-I-Pflanzen wird das Eisen ausserhalb der Zelle reduziert und über Fe2+-Transporter in die Zelle aufgenommen. Gräser (Poaceae) haben im Laufe der Evolution eine zweite Eisenaufnahmestragtegie entwickelt. Sie nehmen Fe3+-Chelate über spezifische Transporter in die Zelle auf und reduzieren das Eisen innerhalb der Zelle. Mit der Etablierung der wässrigen Polymer-zwei-Phasentrennung konnten inzwischen verschiedene Redoxproteine in Plasmamembranen nachgewiesen werden. Hierzu gehören b-Typ Cytochrome, verschiedene NAD(P)H:Oxidoreduktasen und Peroxidasen. Die Struktur, der Elektronentransfermechanismus und die Funktion dieser Redoxsysteme sind einer unserer Forschungsschwerpunkte. Experimentelle Daten weisen auf eine Assoziation von Plasmamembran-Redoxkomponenten mit Mikrodomänen (sogenannten "lipid-rafts") und eine Beteiligung an hochmolekularen Proteinkomplexen hin. Neben physikalisch-chemischen Studien und Lipidanalysen von Plasmamembranen wurden in unserem Labor Proteom-Analysen etabliert, um die Beteiligung von Redoxproteinen an mutmaßlichen Proteinassemblierungen zu untersuchen. Die Zusammensetzung dieser Komplexe hängt vom Entwicklungsstand, den physiologischen Bedingungen und dem untersuchten Pflanzenmaterial ab. Weiterführende Literatur:
|
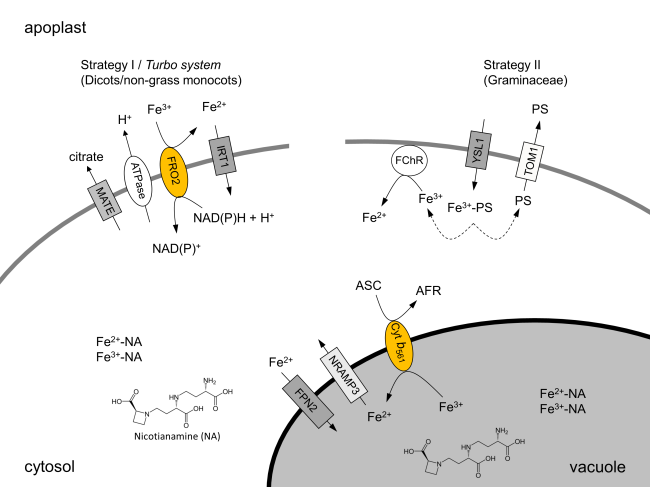
Eisenhomöostase
  |
|
Unser Team zeigte erstmals Veränderungen im Plasmamembranproteom von Erbse (Strategie-I) und Mais (Strategie-II), die durch Eisenmangel bzw. Eisentoxizität induziert wurden. Durch Kombination von Eisenmangel und Elizitierung konnte ausserdem gezeigt werden, dass u.a. Häm-haltige Membranproteine wichtige Funktionen in der Pathogenantwort zukommen. Studien zu Kurzzeit- und Langzeiteffekten geben uns Hinweise über die molekularen Mechanismen bei Eisenstress und der Pathogenantwort sowie der Stressanpassung. Weiterführende Literatur:
|
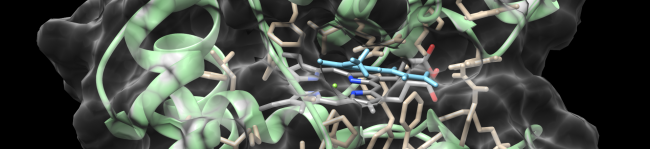
Klasse III Peroxidasen - ROS Produktion & Entgiftung
 |
|
Unser Team hat erstmals Hämperoxidasen in pflanzlichen Plasmamembranen identifiziert. Klasse-III-Peroxidasen sind eine Multigenfamilie mit über 150 Isoenzymen in Mais. Für ca. die Hälfte dieser Enzyme wird eine Membranlokalisation postuliert. Klasse-III-Peroxidasen bilden ein zelluläres Netzwerk aus ROS produzierenden und entgiftenden Enzymen (PeroxiNET), das streng reguliert zu sein scheint. Die spatiotemporale Expression ihrer Gene ist von entscheidener Bedeutung für Entwicklungsprozesse und die zelluläre Stressantwort. Wir haben Protokolle für die Zellfraktionierung und Gel-basierte Proteomanalysen etabliert, um die Regulation und Funktion von Peroxidasen innerhalb dieses Netzwerks in der Pflanzenentwicklung und bei oxidativen Stress zu untersuchen. Neben in silico-Studien zur Struktur und Lokalisierung dieser Proteine werden verschiedene molekularbiologische Methoden zur Funktionsanalyse eingesetzt. Weiterführende Literatur:
|
Biotischer und abiotischer Stress
 |
|
Als sessile Organismen sind Pflanzen multiplen abiotischen und biotischem Stress ausgesetzt. Neben der Eisenhomöostase untersuchen wir die Anpassungen auf Umweltverschmutzung, Wetterextreme und multiplen Stress. Natürliche und industrielle Emissionen verursachen eine Anreicherung von Cadmium und anderen toxischen Elementen in der Umwelt. Ionen dieser Elemente werden von Pflanzen über unspezifische Transporter aufgenommen. Innerhalb der Zelle verursachen sie oxidativen Stress und verändern dadurch den zellulären Redoxzustand. Die molekularen Mechanismen dieser Reaktionen sind nur unzureichend verstanden. Bisher wird die Gesamtperoxidaseaktivität von Proben als allgemeiner Stressmarker für viele Faktoren verwendet. Unser Team erstellte Protokolle, um die Regulierung verschiedener Peroxidase-Isoenzyme gleichzeitig in der selben Probe zu untersuchen. So konnten wir zeigen, dass sich Abundanz und Aktivität verschiedener löslicher, Zellwand- und Membran-gebundener Klasse-III-Peroxidasen unter Cadmium-Exposition veränderten. Durch den Klimawandel kommt es vermehrt zu Hitze, Trockenheit und Überflutungen in der nördlichen Hemisphäre. Durch den Einsatz schwerer landwirtschaftlicher Maschienen kommt es zusätzlich zu einer Bodenverdichtung, wodurch eine Vernässung begünstigt wird. Überflutungen verursachen Veränderungen des pH-Wertes und des Sauerstoffgehaltes (Hypoxie und Anoxie) im Boden und fördern dadurch Eisentoxizität. Wir konnten zeigen das Hypoxie zu Veränderungen der Abundanz von löslichen Peroxidasen und Plasmamembran-gebundenen Redoxsystemen führt. References A. Hofmann, S. Wienkoop, S. Lüthje (2022) Hypoxia-induced aquaporins and regulation of redox homeostasis by a trans-plasma membrane electron transport system in maize roots. Antioxidants 11 (5), 836 C.N. Meisrimler, S. Planchon, J. Renaut, K. Sergeant, S. Lüthje (2011) Alteration of plasma membrane-bound redox systems of iron deficient pea roots by chitosan. Journal of Proteomics, 74: 1437-1449 D. Hopff, S. Wienkoop, S. Lüthje (2013) The plasma membrane proteome of maize roots grown under low and high iron conditions. Journal of Proteomics 91:605-18. C.N. Meisrimler, S. Wienkoop, D. Lyon, C.M. Geilfus, S. Lüthje (2016) Long-term iron deficiency: Tracing changes in the proteome of different pea (Pisum sativum L.) cultivars. Journal of Proteomics 140:13-23. E. Gutierrez-Carbonell, D. Takahashi, S. Lüthje, J.A. Gonzalez-Reyes, S. Mongrand, B. Contreras-Moreira, A. Abadía, M. Uemura, J. Abadía, A.F. López-Millán (2016) A shotgun proteomic approach reveals that Fe deficiency causes marked changes in the protein profiles of plasma membrane and detergent resistant microdomain preparations from Beta vulgaris roots. Journal of Proteome Research, 15(8):2510-24. doi: 10.1021/acs.jproteome.6b00026. C.N. Meisrimler, F. Buck, S. Lüthje (2014) Alterations in Soluble Class III Peroxidases of Maize Shoots by Flooding Stress. Proteomes 2 (3), 303-322 |
