Spiele ohne Grenzen
15. Mai 2019, von Christian Lohr
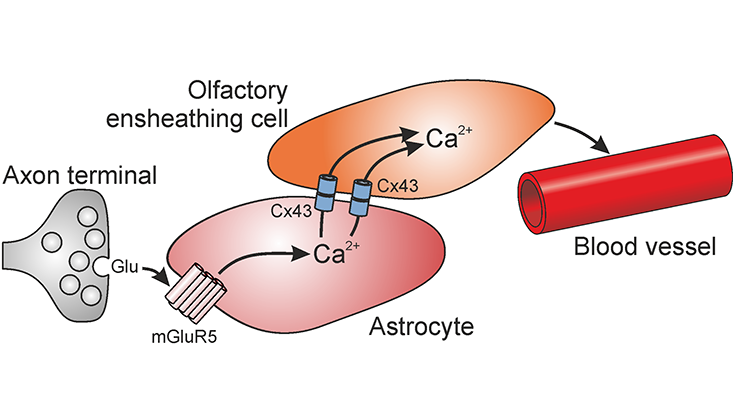
Foto: Antonia Beiersdorfer, Christian Lohr
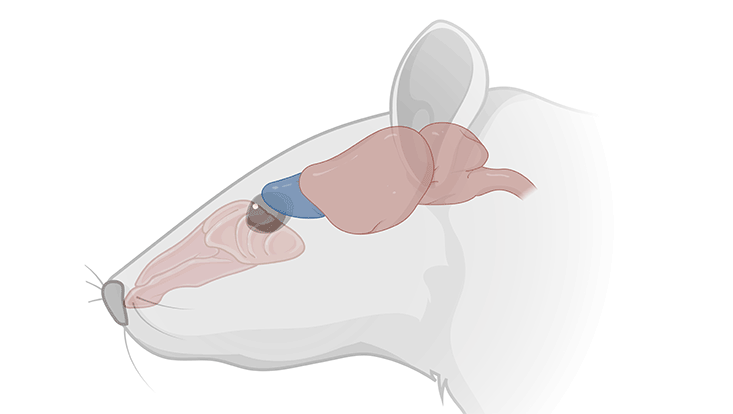
Die Grenze zwischen peripherem und zentralen Nervensystem ist in adulten Säugern ein unüberwindliches Hindernis für auswachsende Neuriten. Zwar sind verletzte oder durchtrennte Axone beispielsweise in Spinalnerven in der Lage zu regenerieren, sie können allerdings nicht ins Rückenmark einwachsen und synaptische Verbindungen knüpfen. Ursache dafür sind reaktive Astrozyten im Zentralnervensystem, die das Nervengewebe vernarben lassen und nach außen hin abschotten. Einzige Ausnahme bildet der Riechnerv, der vom Riechepithel in der Nasenhöhle bis zur ersten olfaktorischen Verschaltungszentrale im Vorderhirn, dem Bulbus olfactorius, zieht. Im Riechnerv findet Regeneration nicht nur nach Verletzung des Riechepithels statt, sondern ist Teil eines andauernden Erneuerungsprozesses. Dieser ist notwendig, da die sensorischen Neurone im Riechepithel, die Riechrezeptorneurone, durch die Atemluft mit Pathgenen und Staub in Berührung kommen, absterben und durch neu gebildete Nervenzellen ersetzt werden. Diese wachsen mit ihrem Axon durch den Riechnerv in den Bulbus olfactorius ein, wobei sie die Grenze zwischen peripherem und zentralen Nervensystem unbehelligt passieren. Ein spezieller Typ von Gliazellen, die olfaktorischen Hüllgliazellen, wird für die permissiven Eigenschaften des Riechnervs verantwortlich gemacht, indem sie die Axone in den Bulbus olfactorius hineinleiten und die Bildung von reaktiven Astrozyten verhindern. Wie dies genau geschieht, ist bislang unklar. Antonia Beiersdorfer aus der Abteilung Neurophysiologie ist dem Geheimnis ein Schritt weit auf die Spur gekommen. Sie konnte zeigen, dass direkte Zell-Zell-Verbindungen über Gap Junctions, welche üblicherweise nur zwischen gleichartigen Zellen ausgebildet werden, olfaktorische Hüllgliazellen und Astrozyten verbinden und somit die Grenze zwischen Peripherie und ZNS verschwimmen lassen. Über diese Gap Junctions werden Signale zwischen den beiden Typen von Gliazellen in Form von Calciumwellen ausgetauscht, die möglicherweise zum Abschalten des restriktiven Verhaltens der Astrozyten führen. Zudem führt die Signalweiterleitung zur Regulation der lokalen Durchblutung des Nervengewebes.
Originalpublikation: Beiersdorfer A, Scheller A, Kirchhoff F, Lohr C. (2019) Panglial gap junctions between astrocytes and olfactory ensheathing cells mediate transmission of Ca2+ transients and neurovascular coupling. Glia. 67:1385-1400. doi: 10.1002/glia.23613.
Kontakt
Antonia Beiersdorfer und Prof. Dr. Christian Lohr
Universität Hamburg
Fachbereich Biologie
Tel.: +49 040 42838 - 5924
E-Mail: antonia.beiersdorfer@uni-hamburg.de, christian.lohr@uni-hamburg.de