Forschung
Die Arbeitsgruppe Stoffwechselphysiologie befasst sich mit der Evolution und den Mechanismen von Anpassungen im Tierreich. Spezifische Themen sind die Stressantwort von Wirbeltieren, die molekularen und zellulären Grundlagen der Toleranz des Gehirns von Meeressäugern gegenüber Sauerstoffmangel, die Evolution und Funktion von Atmungsproteinen, die Verwandtschaftsverhältnisse in den Ecdysozoa und der Arthropoden, und die Evolution der Pathogenität von Malaria.
Durch Anwendung einer Vielzahl molekularbiologischer, proteinbiochemischer, zellbiologischer und bioinformatischer Methoden wollen wir ein funktionelles Verständnis der biologischer Mechanismen gewinnen, die diesen Anpassungen zugrunde liegen.
Stresstoleranz und der molekularen Stressantwort von Fischen
Biologischer Stress kann durch eine Vielzahl von Faktoren verursacht werden, wie z.B. der Mangel an Sauerstoff oder Wasser, Hitze, Kälte, Toxine oder Krankheiten. Auf zellulärer Ebene können diese Stressoren die Makromoleküle (Membranlipide, Proteine, DNA) schädigen. Tiere müssen Stress entweder meiden oder tolerieren. Dabei zeigen sie eine Reihe von molekularen Anpassungen, die es ihnen erlauben, den Stresszustand besser zu überstehen.

Viele Fischspezies sind in ihrer aquatischen Umgebung schwankenden oder stark reduzierten Sauerstoffbedingungen ausgesetzt. Auch sind viele Fische anthropogen verursachten Wasserverschmutzungen ausgesetzt, die häufig ebenfalls zu einer reduzierten Verfügbarkeit des Sauerstoffs führen. Mittels vergleichender Proteom- und Transkriptomuntersuchungen sollen die molekularen Mechanismen der Stressantwort bei Fischen aufgeklärt werden (Roesner et al., 2006; Roesner et al., 2008; Tiedke et al., 2013; Tiedke et al., 2014; Tiedke et al., 2015).
Das Gehirn auf Tauchstation: Hypoxietoleranz des Gehirns von Walen und Robben
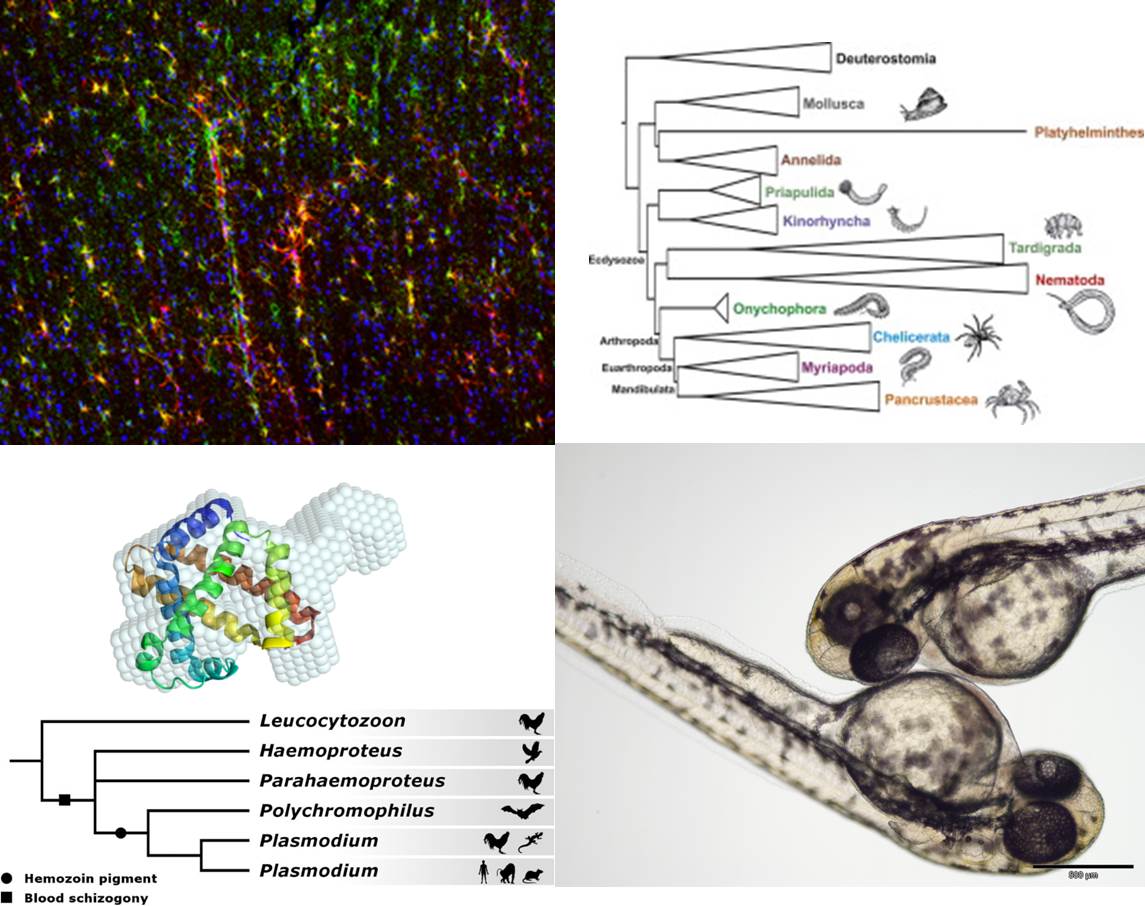
Das Gehirn vieler tauchender Säuger ist unter Wasser regelmäßig Sauerstoffmangel (Hypoxie) ausgesetzt. Elektrophysiologische Untersuchungen haben gezeigt, dass die Neurone des Gehirns der tief tauchenden Klappmützenrobbe wesentlich toleranter gegenüber hypoxischen Bedingungen sind als die der Maus. In Zusammenarbeit mit der AG Folkow (Universität Tromsø, Norwegen) untersuchen wir die molekularen und biochemischen Grundlagen der Hypoxietoleranz des Gehirns von Walen und Robben. Wir konnten zeigen, dass die Hypoxietoleranz des Klappmützenhirns mit einer Verlagerung des oxidativen Stoffwechsels in die Astrozyten verbunden ist, wohingegen im Gehirn terrestrischer Tiere der aerobe Stoffwechsel hauptsächlich in Neuronen stattfindet (Mitz et al., 2009). Wale hingegen zeigen eine ähnliche Verteilung von Stoffwechselenzyme wie ihre terrestrischen Verwandten. Allerdings besitzen sie im Gehirn wesentlich mehr Neuroglobin als z.B. Kühe (Schneuer et al., 2012). Elektrophysiologische Studien zeigten, dass die Gehirnneurone der Klappmützenrobbe auch außerordentlich tolerant gegenüber geringen Glucose oder hohen Laktatkonzentrationen sind (Czech-Damal et al., 2014; Hoff et al., 2016). Ferner wurden durch vergleichende Transkriptomanalysen Gene identifiziert, die wesentlich an der Stresstoleranz des Gehirn tauchender Säuger beteiligt sind. Ihre genaue Funktion wird aktuell untersucht.
(Unterstützt von der DFG 2009-2013)
Evolution und Funktion von respiratorischen Proteinen
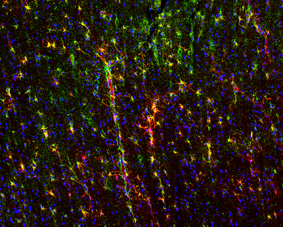
Das Leben auf der Erde ist unter sauerstofffreien Bedingungen entstanden. Mit der Evolution der Photosynthese im Proterozoikum vor mehr als 2 Milliarden Jahren akkumulierte der Sauerstoff in der Atmosphäre. Während Sauerstoff zunächst als starkes Toxin wahrscheinlich zu einem der größten Aussterbeereignisse führte, dient er heute in der Atmungskette der Mitochondrien als Elektronenakzeptor und erlaubt eine effiziente Gewinnung metabolischer Energie. Allerdings benötigen Tiere effiziente Mechanismen zur Aufnahme von ausreichend Sauerstoff. Neben Atmungsorganen, Kreislaufsystemen sind hierfür in erster Linie die so genannten respiratorischen Proteine verantwortlich: (Hämo-)Globine, Hämerythrine und Hämocyanine. Die Evolution und Funktion der Globine und Hämocyanine stehen im Mittelpunkt des Interesses der Arbeitsgruppe.
1) Blaues Blut: Function and evolution of the arthropod hemocyanin superfamily
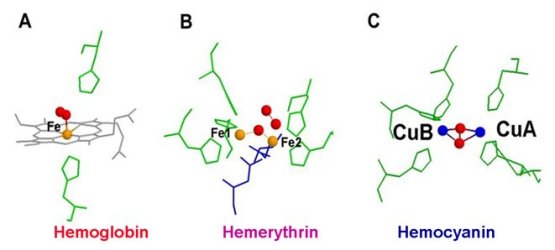
Hämocyanine sind respiratorische Kupferproteine, die in Arthropoden dem Transport von Sauerstoff dienen (Burmester, 2002; Burmester, 2015). Während Hämocyanin in den Spinnentieren und malakostraken Krebsen gut untersucht ist, war sein Vorkommen in anderen Arthropoden unbekannt bzw. wurde in der Literatur bestritten. Durch unsere Studien der letzten Jahre wurde das Wissen über die Verbreitung und die Evolution von Hämocyanin erheblich erweitert. Lange Zeit wurde angenommen, dass auch Hexapoden (Insekten) kein Hämocyanin brauchen, sondern das Tracheensystem zur Sauerstoffversorgung ausreicht. Tatsächlich jedoch konnten wir zeigen, dass in den meisten basalen Insekten Hämocyanin besitzen (Hagner-Holler et al., 2004; Pick et al., 2009). Damit steht die Frage im Raum, welche Bedeutung das Hämocyanin neben dem Tracheensystem besitzt, und wieso es in "höheren" Insekten verloren ging. Diese Frage untersuchen wir in verschiedenen Insektenspezies mittels genetischer und sowie mittels rekombinanten Hämocyanin.
(Unterstützt von der DFG 1999-2014)
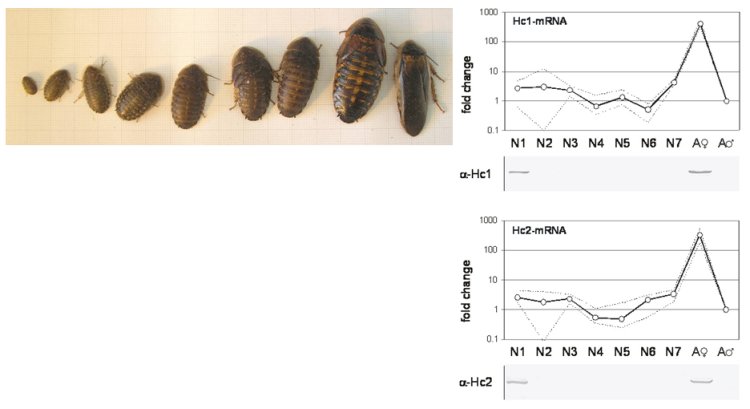
2) Die Funktion und Verbreitung intrazellulärer Globine bei Insekten
Globine sind kleine Eisen-Häm-Proteine die Sauerstoff reversibel binden und daher eine wichtige Rolle in der Atmung der Tiere und in der oxidativen Energiegewinnung spielen. Lange Zeit wurde angenommen, dass Insekten keine Hämoglobine besitzen. Lediglich wenige an Sauerstoffmangel angepasste Arten galten als Ausnahme. Wir konnten jedoch zeigen, dass (Hämo-)Globine in Insekten weit verbreitet sind (Burmester and Hankeln, 1999; Burmester and Hankeln, 2007). Ihre genaue Funktion ist jedoch unklar, insbesondere, ob sie tatsächlich die Sauerstoffversorgung verbessern. In Zusammenarbeit mit der AG Hankeln (Universität Mainz) untersuchen wir die Funktion der Globine der Modell-Spezies Drosophila melanogaster (Burmester et al., 2006) mittels Manipulation der Sauerstoffkonzentration, ektopischer Überexpression (Gleixner et al., 2008) und RNAi-vermittelten Gen-Knockdowns in vivo (Gleixner et al., 2016), sowie in transfizierten Zelllinien in vitro. Die Ergebnisse zeigen, dass das v.a. in Tracheolen und Fettkörper stark exprimierte Globin 1 die Sauerstoffversorgung der Zellen verbessert. Die Globine 2 und 3 werden spezifisch im Hoden exprimiert werden und sind sehr wahrscheinlich für die Fertilität von Bedeutung. Durch bioinformatische Analysen konnte die Verbreitung von Globinen in Insekten-Genomen systematisch analysiert und dabei drei grundlegende, weit verbreitete Globingen-Typen identifiziert werden, die strukturell und funktionell unterschiedlich sind.
3) Neue Familienmitglieder: Funktionelle Analysen von Neuroglobin und Cytoglobin
Hämoglobin und Myoglobin zählen zu den am besten untersuchten Proteinen in der biomedizinischen Forschung und dienen als Modellsystem zur Untersuchung von Evolution und Funktion von Proteinen. Unsere Studien der letzten Jahre führten zur Entdeckung von sechs weiteren Globintypen der Wirbeltiere: Neuroglobin (Burmester et al. 2000), Cytoglobin (Burmester et al. 2002), Globin X (Roesner et al., 2005), Globin Y (Fuchs et al., 2006), Globin E (Kugelstadt et al.; Blank et al., 2011), und Androglobin (Hoogewijs et al., 2012). Die Funktionen dieser "neuartigen" Globine sind jedoch weitgehend ungeklärt. Durch Untersuchungen der Verwandtschaft, des Globinrepertoires und der Syntenie (Genanordnung) in den Globinregionen soll die Evolution der Globine nachvollzogen werden (Burmester and Hankeln, 2014). Weiterhin untersuchen wir die Evolution und Expression von Globinen in evolutiv "interessanten" Spezies, wie z.B. Neunaugen (Schwarze et al. 2014 ; Rohlfing et al. 2016), Quastenflosser (Amemiya et al. 2013; Schwarze et al., 2013), Lungenfischen und Schildkröten (Schwarze et al. 2015). Funktionelle Untersuchungen werden anhand stabil transfizierter Zelllinien durchgeführt. Dabei soll die Fähigkeit der einzelnen Globine ermittelt werden, Toleranz gegenüber Hypoxie und reaktiven Sauerstoffspezies zu vermitteln (Koch et al. 2016), sowie die Rolle beim Schutz von Lipiden, bei der Generation von ROS und NO, bei der mitochondrialen Respiration und in der Apoptose analysiert werden.
(Unterstützt von EU und DFG 2000)
Funktionelle Analyse intrazellulärer Globine von Zebrafischen
(Hämo-)Globine gehören zu den am besten untersuchten Proteinen in den Biowissenschaften, bieten aber immer noch Überraschungen. Unsere Studien führten zur Entdeckung von sechs neuartigen Globinen bei Gnathostamata (Kiefermünder), deren Funktionen meist noch nicht gut aufgeklärt sind. In diesem Antrag möchten wir die Funktionen von Cytoglobin (Cygb1 und Cygb2), Neuroglobin (Ngb) und Globin X (GbX) im Zebrafisch Danio rerio untersuchen. Wir werden die CRISPR/Cas9-Methode verwenden, um Knockouts der verschiedenen Globin-Gene zu erzeugen. Zur Etablierung der Methode wurde von uns bereits eine Cygb1-Knockout-Zebrafisch-Linie erzeugt.
Die Globin-Knockouts werden auf Entwicklungsdefekte, Veränderungen im O2-Verbrauch, Hypoxietoleranz und -Antwort, Schutz vor reaktiven Sauerstoffspezies (ROS) und Stickstoffmonoxid, sowie bezüglich des Schutz' von Membranlipiden getestet. Weiterhin soll eine vergleichende RNA-Seq-Analyse (Knockout vs. Wildtyp) dazu dienen, die entsprechenden Stoffwechselwege zu identifizieren, in denen die Globine beteiligt sind. Ngb könnte nach unserer Vermutung an der O2-Versorgung oder am ROS-Abbau beteiligt sein, während GbX möglicherweise die Zellmembran schützt.
Im Gegensatz zu anderen Wirbeltieren besitzen Knochenfische zwei verschiedene Cygb-Gene. Wir vermuten, dass sie durch Subfunktionalisierung nach der Genduplikation divergierten. Die duplizierten Cygb-Gene könnten eine Rolle bei der Bereitstellung von O2 für die Kollagensynthese, beim Schutz vor ROS oder im NO-Stoffwechsel spielen. Es wird erwartet, dass die Ergebnisse die physiologischen Rollen von Ngb, Cygb1, Cygb2 und GbX insbesondere in Zebrafisch aufklären, und zudem helfen, die funktionelle Vielfalt der Globine bei Wirbeltieren im Allgemeinen besser zu verstehen.
(Unterstützt von der DFG 2018-2021)
Phylogenie der Ecdysozoa und Arthropoda
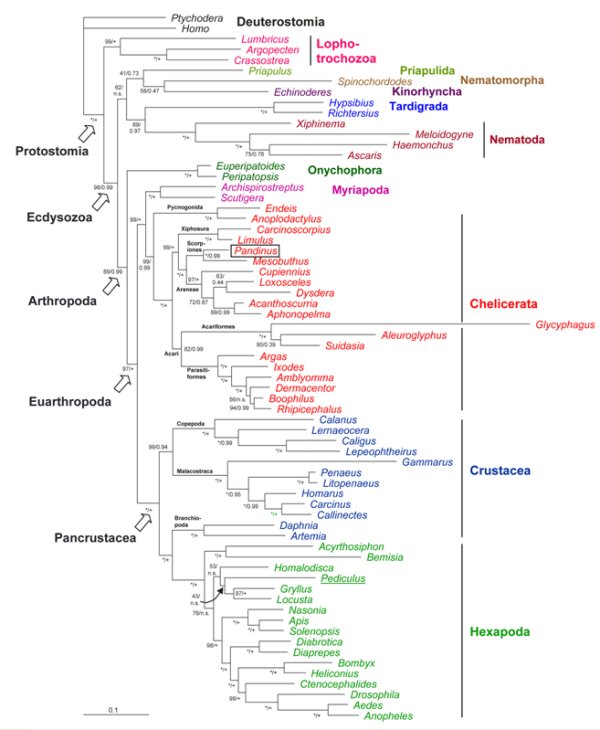
Die Arthropoden (Gliederfüßer) sind wohl der vielfältigste Tierstamm, doch sowohl seine Position in den Protostomia als auch die Verwandtschaftsverhältnisse zwischen verschiedenen Arthropoden-Taxa galt als lange unsicher. Mittels phylogenomischer Techniken der Analyse großer Sequenzdatensätze ist es in den letzten Jahren gelungen, die Verwandtschaftsverhältnisse innerhalb der Ecdysozoa im Allgemeinen und der Arthropoden im Speziellen besser aufzulösen. Innerhalb der Ecdysozoa wurden die Kinorhyncha (Hakenrüssler) als Schwestergruppe der Priapulida (Priapswürmer) identifiziert (Borner et al., 2014). Dieses Taxon (d.h. Scalidophora) steht innerhalb der Ecdysozoa basal. Die Position der Tardigraden (Bärtierchen) ist unsicher, doch sprechen die Sequenzdaten für eine Verwandtschaft mit den Nematoden (Fadenwürmer). Die Schwestergruppe der Euarthropoden stellen die Onychophora (Stummelfüßer) dar (Roeding et al. 2007). Innerhalb der Euarthropoden wurden die Monophylie der Mandibulata (d.h., Myriapoda, Crustacea, Hexapoda) bestätigt, allerdings sind die Myriapoden (Tausendfüßer) keineswegs den Hexapoden (Insekten im weiteren Sinn) nahe verwandt (Meusemann et al., 2010; Rehm et al., 2014). Die Crustaceen (Krebstiere) sind die nächsten Verwandten der Hexapoden und sind paraphyletisch in Bezug auf dieses Taxon. Die nächsten Verwandten der Hexapoden stellen nach eigenen Ergebnissen die erst vor 30 Jahren entdeckten Krebstiere der Klasse der Remipedia dar (Ertas et al., 2009). Weiterhin wurde anhand einer molekulare Uhr und anderer Methoden die Aufspaltungszeitpunkte innerhalb der Ecdysozoa und Arthropoden bestimmt werden (Rehm et al., 2011).
(Unterstützt von der Deutsche Forschungsgemeinschaft 2005 – 2011)
Evolution der Pathogenität von Malaria
Mit jährlich ca. 650.000 Millionen Todesfällen und 500 Millionen Erkrankten gehört Malaria weltweit zu den häufigsten und gefährlichsten Infektionskrankheiten des Menschen. Malaria wird von Protozoen der Gattung Plasmodium verursacht, die von Anopheles-Mücken übertragen werden. P. falciparum ist der Erreger der gefährlichsten Form dieser Krankheit, die üblicherweise auf tropische Gebiete beschränkt ist. Die besondere Pathogenität von P. falciparum wird durch Mechanismen verursacht, die entweder spezifisch für diese Art sind, oder bereits früher in der Evolutionslinie dieses Taxon entstanden sind. Wir untersuchen phylogenetische, molekulare und zellbiologische Ansätze integrieren um die Evolution der Wirtszell-Parasit-Beziehungen zu verstehen. In diesem Zusammenhang ermitteln wir die Stammesgeschichte der Haemosporida (Borner et al., 2016), einem Taxon, das neben Plasmodium noch weitere Blutparasiten umfasst. Parasit-Wirtszellen-Beziehungen sollen durch Untersuchungen des Proteinexports aus dem Plasmodium Parasiten zur Zelloberfläche der Erythrozyten und durch Untersuchung der Interaktion zwischen Wirts- und Parasit-Proteinen verstanden werden (Schulze et al., 2015).
(Unterstützt von der DFG seit 2013).
